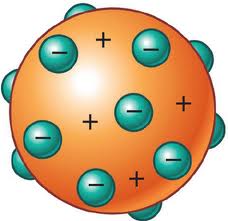
Atomic models

Modely atómu
Prebrané zo stránky : https://www.oskole.sk/?id_cat=3&clanok=7597
Vypracovala: B. Horváthová
Atóm je základná stavebná častica látky. Atóm sa skladá z atómového jadra a elektrónového obalu. Počet protónov Z v jadre sa nazýva protónové číslo a určuje elektrický náboj jadra Q = Z*e.
Už v starom Grécku filozofovia Leukippos a Demokritos formulovali hypotézu, že látka sa skladá z atómov, častíc, ktoré nie je možné deliť na menšie častice . Atomos – znamená nedeliteľný.
Známy je Thomsonov model atómu, pudingový model. Predpokladal, že atóm je kladne nabitá guľa v ktorej sú rovnomerne rozptýlené elektróny. Elektróny sú rozložené podobne ako hrozienka v anglickom pudingu. Tento model navrhoval v roku 1904 pred objavom atómového jadra.

E. Rutherford v roku 1911 ostreľoval veľmi tenkú zlatú fóliu časticami α . Ak by platil pudingový model, mali by sa častice prechodom cez fóliu odchyľovať len nepatrne. Pri pokusoch dochádzalo aj k veľkým odchýlkam od pôvodného smeru. Z výsledkov pokusov usúdili, že všetok kladný náboj je sústredený v jeho jadre, ktoré je oveľa menšie než celý atóm. Rutherford určil veľkosť jadra atómu rádovo 10-14 m až 10-15m.
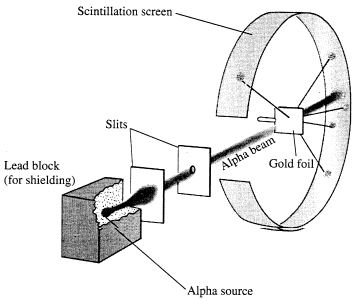



.png)


Rutherfordov model atómu predpokladal, že okolo kladne nabitého jadra krúžia elektróny so záporným nábojom . Nazýva sa aj planetárny model – elektróny obehajú okolo jadra podobne ako planéty okolo Slnka. Elektrón pohybujúci sa po kružnici okolo jadra podľa Maxwellovej teórie mal vyžarovať elektromagnetické žiarenie, tým by strácal kinetickú energiu a rýchlo by sa približoval k jadru. Atóm by bol nestabilný. Avšak atómy patria medzi najstabilnejšie objekty.
Problémy sa pokúsil vyriešiť dánsky fyzik Niels Bohr. Bohrov model atómu: atóm je stabilná sústava zložená z kladne nabitého jadra a z elektrónového obalu, v jadre je sústredená takmer celá hmotnosť atómu, elektrón sa môže bez vyžarovania energie pohybovať okolo jadra len po určitých dráhach, môže sa nachádzať iba v určitých kvantových stacionárnych stavoch. Každému kvantovému stavu je priradené hlavné kvantové číslo. Pri prechode elektrónu zo stacionárneho stavu s energiou En do stavu s nižšou energiou Em môže atóm vyžiariť fotón s frekvenciou fnmurčenou vzťahom hfnm = En - Em, tento jav je emisia.
Na obrázku sú znázornené energetické hladiny atómu vodíka. Záporná hodnota energetických hladín znamená, že na uvoľnenie elektrónu z atómu je potrebné dodať mu kladnú energiu rovnajúcu sa aspoň absolútnej hodnote En.
Stacionárny stav elektrónu v elektrónovom obale atómu s najnižšou hodnotou energie E1 sa nazýva základný stav a zodpovedá mu hlavné kvantové číslo n = 1. Stavy elektrónu s vyššou hodnotou energie En sa nazývajú excitované stavy.
Atóm, ktorého aspoň jeden elektrón sa nachádza v excitovanim stave, sa nazýva excitovaný atóm, hovoríme, že sa nachádza v excitovanom stave.
Ión vzniká z atómu alebo molekuly týmto spôsobom: katión vznikne odtrhnutím jedného alebo viacerých záporných elektrónov, anión vznikne pripojením jedného alebo viacerých elektrónov k neutrálnej molekule alebo atómu a má záporný náboj.
Kvantovo mechanický model atómu vodíka vyplynul z riešenia Schrodingerovej rovnice pre elektrón v centrálnom poli jadra. Orbitál je miesto s 90% pravdepodobnosťou výskytu elektrónu v atóme. Vlnové funkcie sú pre jeden elektrón v centrálnom elektrickom poli jadra atómu charakterizované tromi kvantovými číslami. Hlavné kvantové číslo n určuje energiu príslušného stacionárneho stavu elektrónu, nadobúda hodnoty n = 1, 2, 3, 4, ...
Vedľajšie kvantové číslo (orbitálové ) súvisí s orbitálovým momentom hybnosti nadobúda hodnoty l = 0, 1, 2, .., n – 1.
Magnetické kvantové číslo m súvisí s magnetickým dipólovým momentom a nadobúda hodnoty m = 0, ± 1, ± 2, ± 3, ..., ± l.
Rozhodujúcim krokom pri dešifrovaní štruktúry atómov bol objav Pauliho princípu v roku 1924: V určitom stcionárnom stave atómu , opísanom kvantovými číslami n, l, m môžu sa nachádzať nanajvýš dva elektróny.
Hodnoty energie stacionárnych stavov elektrónov nazývame energetické hladiny. V základnom stave atómu elektróny obsadzujú hladiny s najnižšími energiami, ale tak aby bol splnený Pauliho princíp. V atóme nemôžu byť dva elektróny, ktoré by mali všetky štyri kvantové čísla rovnaké.
Štvrté spinové kvantové číslo sa prejavuje tak, že elektrón sa správa ako malý magnet, ktorý vzhľadom na smer vonkajšieho magnetického poľa môže mať iba dve orientácie.
Rozdelenie elektrónov atómov do jednotlivých energetických hladín sa volá elektrónové konfigurácie. Napríklad: vodík má jeden elektrón v stave 1s , je jednoväzbový. Hélium má dva elektróny v stave, zaplnená hladina má súvis s neochotou hélia vstupovať do chemických reakcií. Lítium má elektrónovú konfiguráciu (1s)2(2s)1 elektrón vstave 2s je slabšie viazaný a zúčastňuje sa v chemickej väzbe , lítium je jednoväzbové.
Chemické vlastnosti prvkov úzko súvisia s ich elektrónovou konfiguráciou.
Úlohy:
1) Čo objavil Rutherford a aký model atómu vytvoril?
2) Aké kvantové čísla poznáme a čo charakterizujú?
3) Vyslovte Pauliho princíp.
Použitá literatúra:
-
Ján Pišút akol. Fyzika pre 4.ročník
-
Pavol Tarábek a kol. Zmaturuj z fyziky
Obrázková príloha:
-
Pavol Tarábek a kol. Zmaturuj z fyziky
https://www.youtube.com/watch?v=X2uvuSThtuI
https://www.youtube.com/watch?v=ajQEvtge0m0
https://www.youtube.com/watch?v=XLaeFUKd2Y4
www.youtube.com/watch?v=P8A7qwDMcwo
an object.qwDMcwo





History
https://www.vigyanprasar.gov.in/dream/may2001/electron.htm